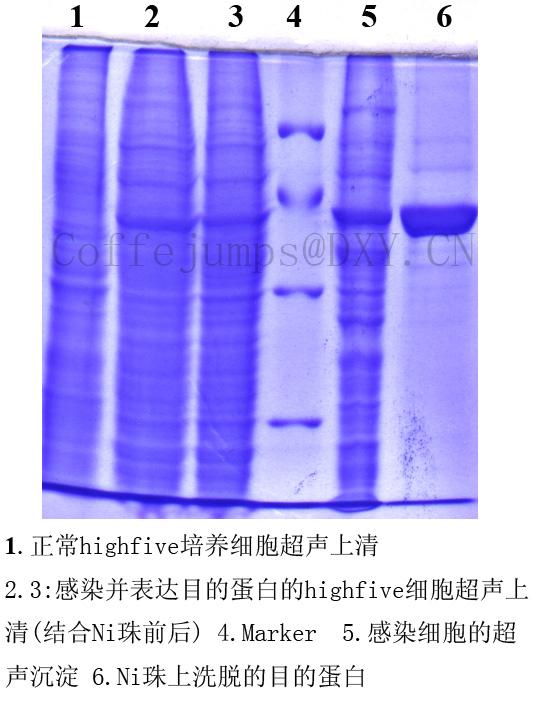
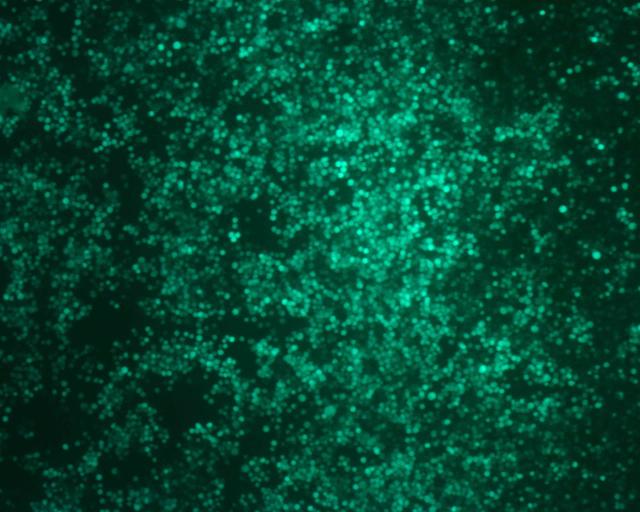
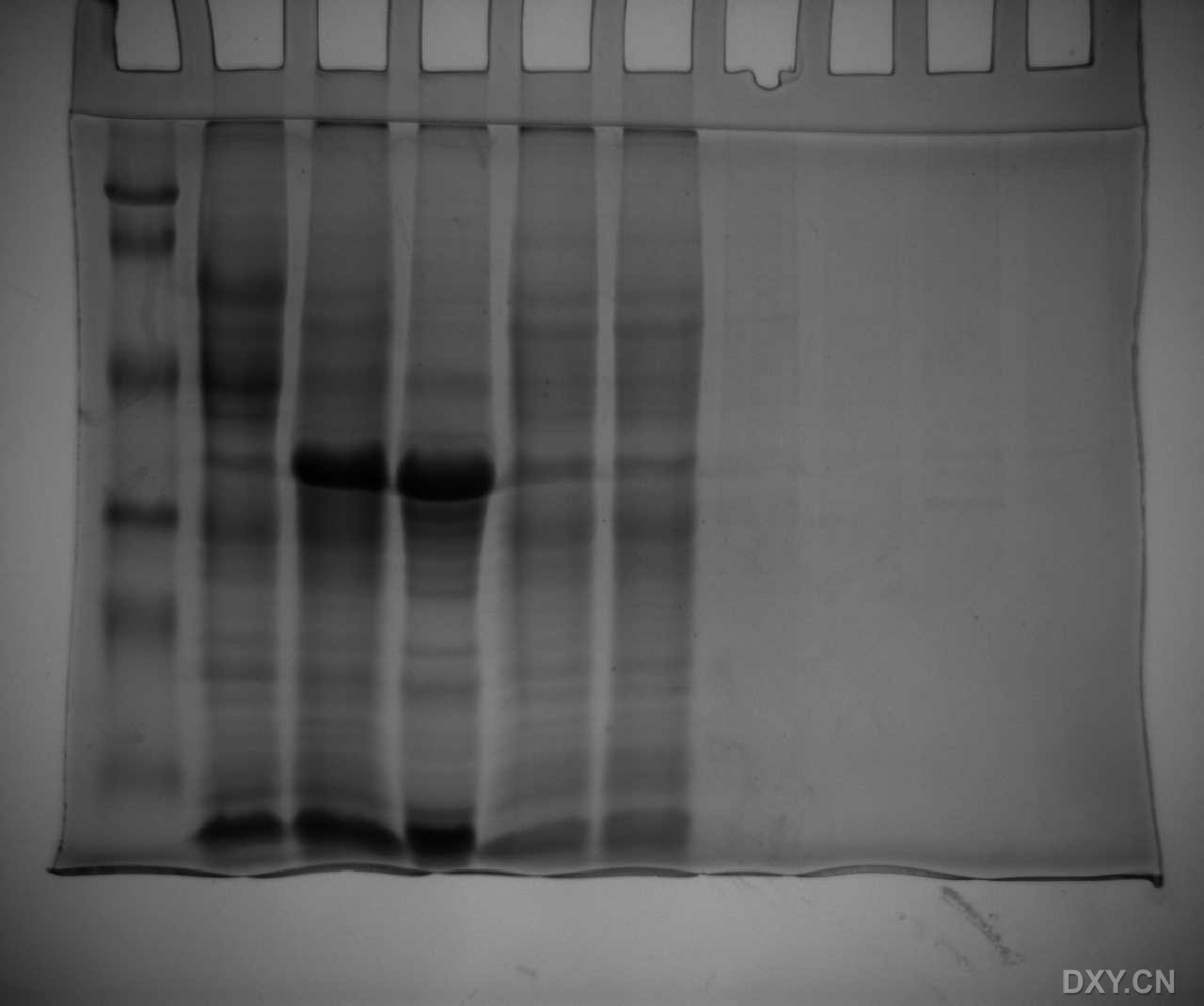
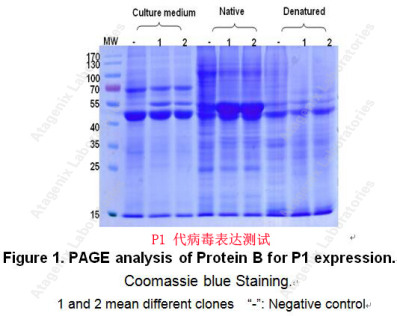
QUOTE:
原帖由 duoduo 于 2013-5-11 16:31 发表 bbcodeurl('http://bbs.antpedia.com/images/common/back.gif', '%s')
我们使用的胰酶过了有效期,浓度是0.5%(1640配制),一般0.25%就好了。消化很快呀(3-5min),你再试试。
You are welcome. Good luck!
================================
想请假下sf9和sf21哪个细胞更好一点儿? ...
我们使用的胰酶过了有效期,浓度是0.5%(1640配制),一般0.25%就好了。消化很快呀(3-5min),你再试试。
You are welcome. Good luck!

================================
想请假下sf9和sf21哪个细胞更好一点儿? ...