
正交试验法优选香砂养胃丸最佳打光工艺


GMP认证前25项最后提醒
提升中药注射剂无菌保证水平
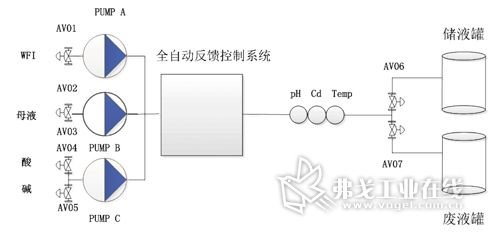
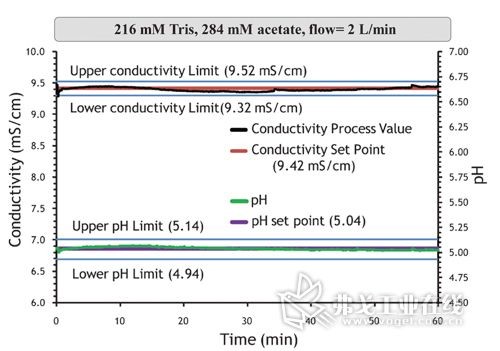
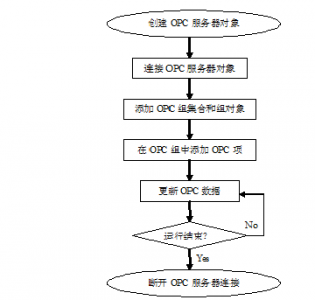
中药提取浓缩生产过程的自动控制



消毒检测一次完成
无菌药品质量控制的注意要点
GMP洁净区干雾化过氧化氢空间灭菌系统简介
冻干工艺配制中的药液过滤

加强除菌过滤器的质量管理 有效降低注射剂类产品的无菌风险
冻干粉针工艺
粉针剂认证要点
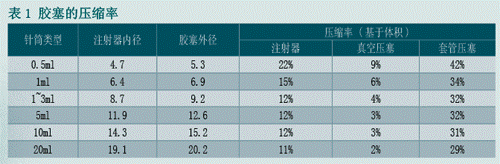
浅淡注射器的压塞技术


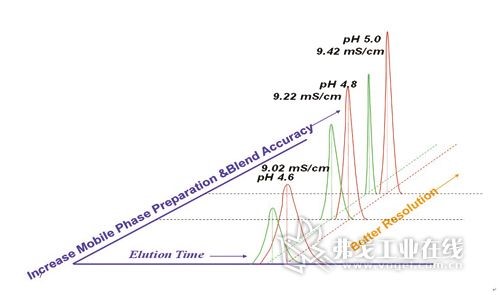
树立QbD理念以更好地保证产品的最终质量及用药安全


把风险降低到最小程度--避免无菌生产线的设计错误
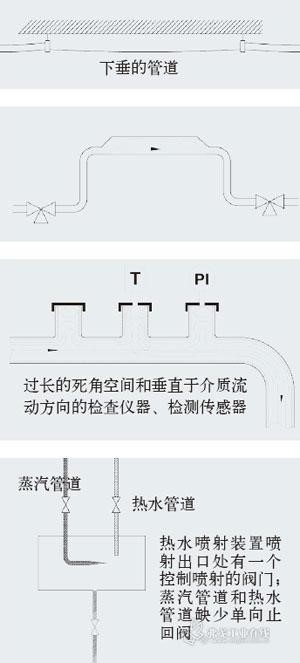
冻干过程的几个关键概念
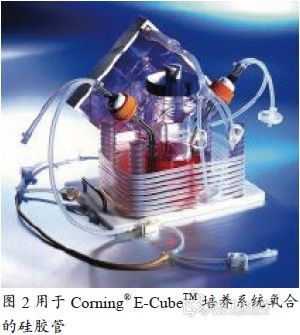
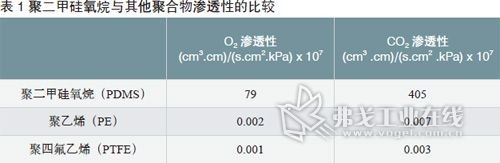
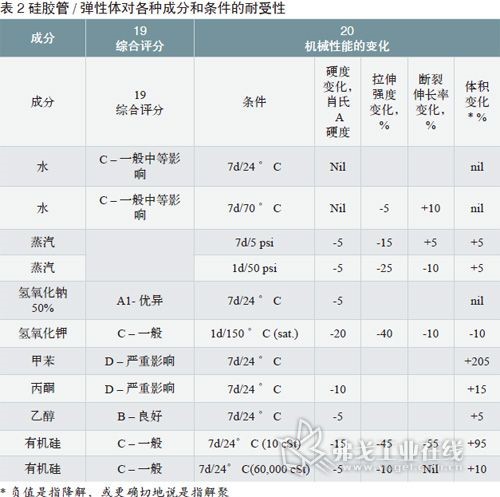
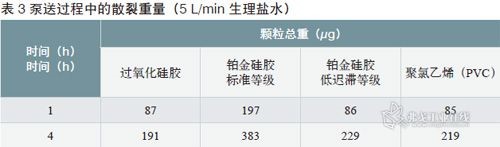
制药级硅胶管的优点和局限性
多级喷雾干燥塔的设备运行规则
喷雾干燥塔的能源节约
冻干设备应改进的问题解析
冻干技术在基因工程药物中的应用
冻干制剂经验谈
牛血清的作用与质量要求
细胞培养从头学
发酵工业杂菌污染的控制技术
新药(IND)除菌过滤的验证和确认
制粒技术
制粒过程的质量控制
制粒技术
真正实现无菌转移


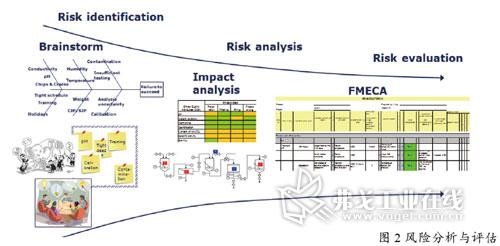
质量风险管理连接质量管理与精益生产

制药行业的干燥装置
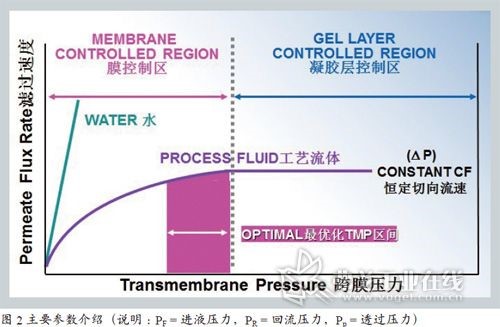
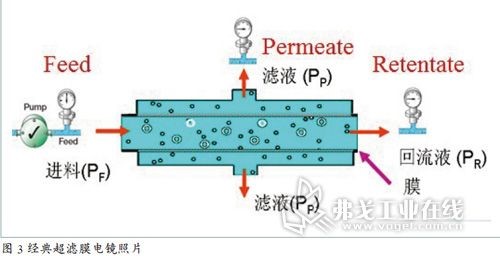
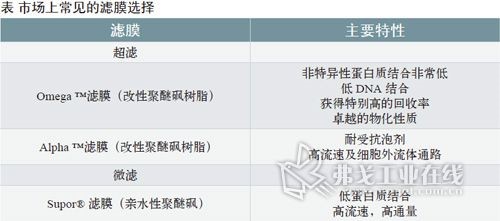
切向流过滤技术的原理和应用

]湿热灭菌法
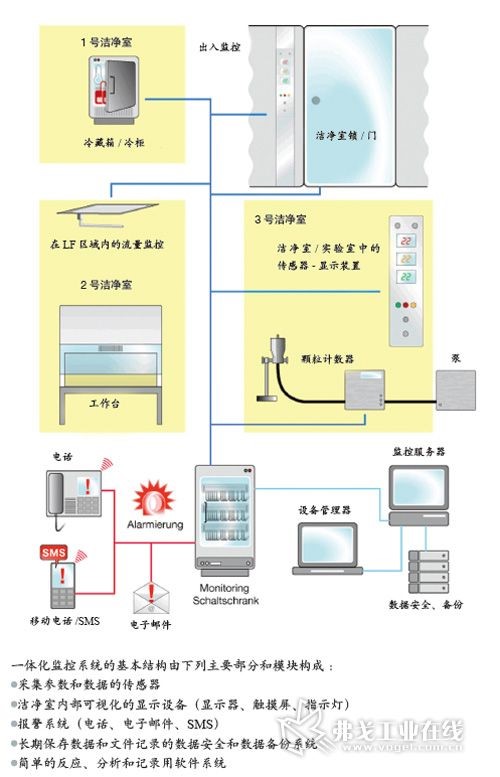
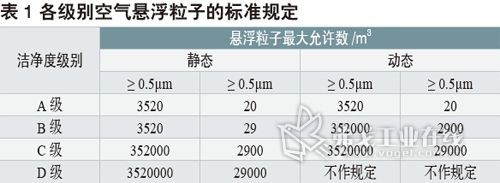
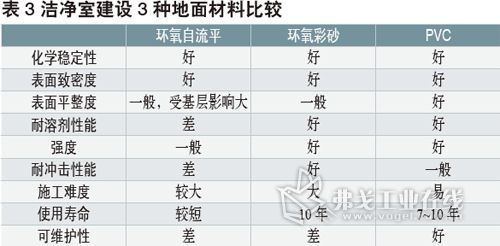
让洁净室工作更高效--洁净室连续监控系统设置和使用的几点建议
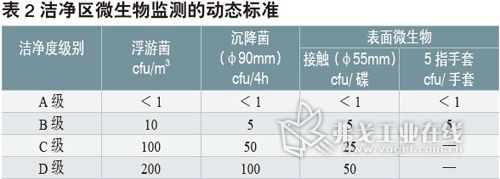
最大限度防控微生物污染
制药废水深度处理技术的研究
技术转移的差距分析6Ms运用
无菌生产工艺设计与风险控制
正确称重的实践建议
温湿度验证/分布研究的5个常见问题
无菌检查方法的验证
冻干工艺配制中的称量
冻干制剂经验谈
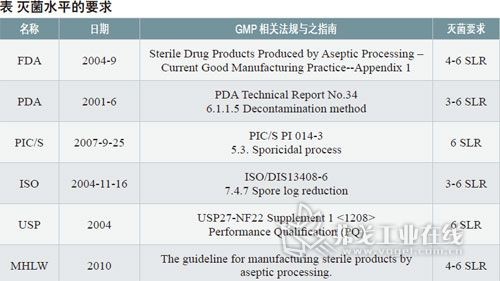
浅谈过氧化氢蒸汽灭菌与验证的相关问题

高效过滤器DOP检漏法在制药企业中的应用
探讨除菌级过滤器的重复使用(下)

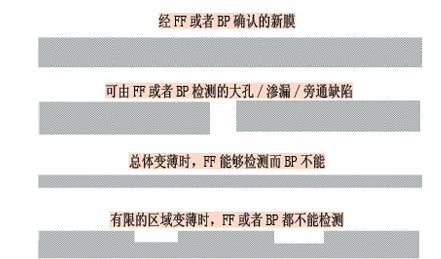
探讨除菌级过滤器的重复使用(上)
浅谈螺杆空压机的工作原理与流程
片剂生产总结(三)-包衣
片剂生产工艺总结(二)
片剂生产工艺总结(一)
解决中药注射剂澄明度的方法有哪些??
医药瓶设计中值得注重的几大因素
浅谈我国药用包装机械如何适GMP发展的需要
包装企业应怎样配备检测仪器?
针对目前常见药品包装质量问题的专家解答
国外瓶装片剂数颗机中通道式喂料器的观察与探讨




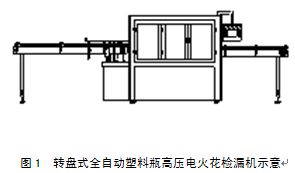
口服液洗瓶机所存在的问题
隧道式灭菌干燥机验证指标
新一代高速轧盖机研发思路及其特点
抗生素药物包装中丁基胶塞使用的有关问题
注射剂产品直接接触药品的包装材料和容器的选择考虑
直接接触的塑料包装材料指南(欧盟/欧洲药品管理局)
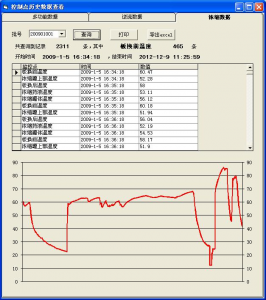
中药生产控制系统数据库二次开发
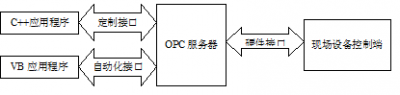
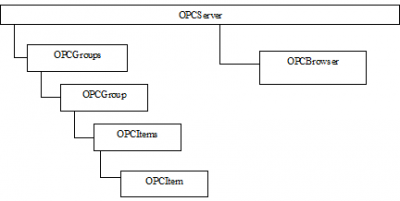
药厂微生物实验室的最佳实践
制剂如何通过TGA现场检查或认证
正确认识卫生型仪表及其合规性要求
湿法制粒小经验
抗生素玻璃瓶灌装加塞机的故障与排除
| 欢迎光临 分析测试百科 (http://bbs.antpedia.com/) | Powered by Discuz! 5.5.0 |