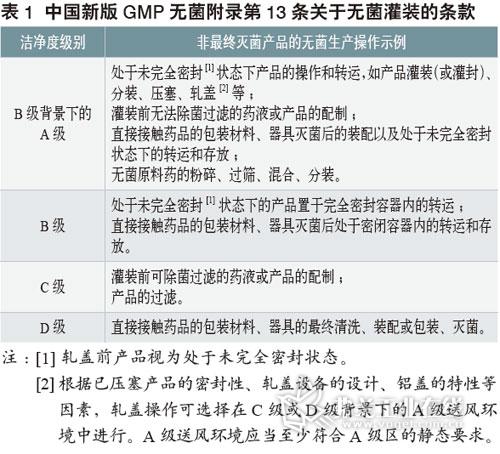
美国仿制药生物等效性评价的意义及方法
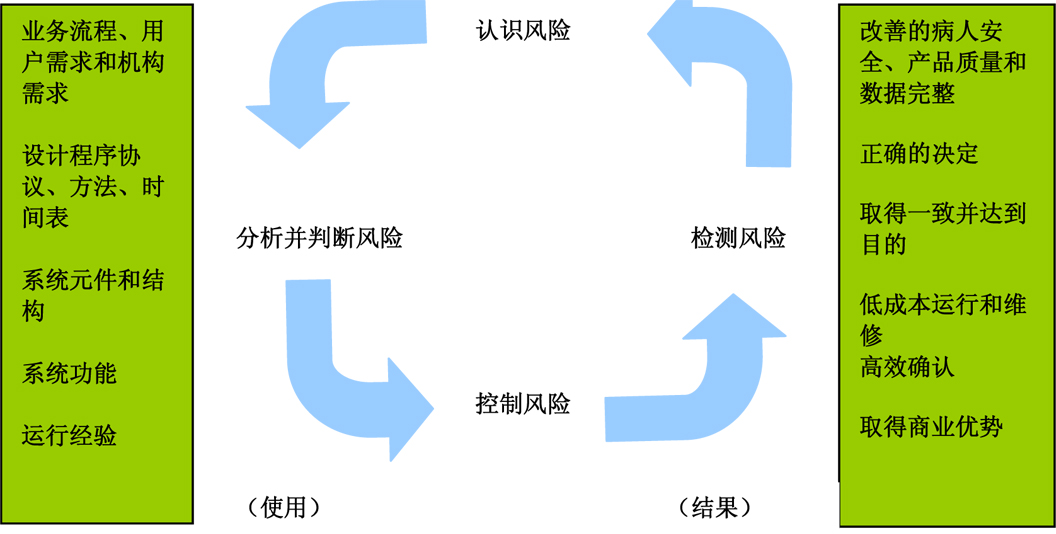
在生物等效性评价不仅仅用于仿制药批准的过程中,同时在新药开发、新药生产工艺和剂型变换的过程中,也发挥着非常重要的作用。在美国,任何仿制药品上市,都必须经由美国食品药品监督管理局(FDA)批准。仿制药生产厂家须出示数据证明受试药品(仿制药品)与参比药品(原研药品)具有药学和生物等效性。生物等效性是指在相同的试验条件下,给予相同剂量的两种药学等效制剂,其活性成分吸收程度和速度无显著差异。在前几期的“FDA华人系列”专栏里,我们讨论了美国FDA仿制药药品的法规和审批程序及质量审评。本文将着重讨论美国仿制药的生物等效性评价。
生物等效性评价的价值和重要性
在仿制药申请的过程中,生物等效性评价占据着极其重要的地位。生物等效性评价可证明受试药品与参比药品以同样的速度和程度被人体吸收。两个药学等效的药品制剂,只有在生物等效试验中被确认为生物等效时,这两种药品方可被认定在临床上的疗效是等效的。对于仿制药品来讲,如果与原研药品临床等效,且在服用过程中遵循原研药品的服药规则,则应与原研药品具有相同的有效性和安全性。由此可见,生物等效性评价是仿制药审评和服用的基础。
生物等效性评价不仅仅用于仿制药批准的过程中,同时在新药开发、新药生产工艺和剂型变换的过程中,也发挥着非常重要的作用。例如,新药开发的过程中,拟上市药品在剂型和生产工艺上,都有可能与临床试验用药品有所区别。这种区别可能源于生产厂家在由小批量生产扩大到大批量生产的过程中,对药物剂型和生产工艺进行了相应修改;或是新药产品被批准上市后,生产厂家对其生产设备、生产工艺、药物剂型、原料质量标准、原料来源、原料药的生产方法等等,进行相应的改进,在这个过程中,变更前产品必须与变更后产品生物等效,以确保变更后产品的安全性和有效性。
生物等效性评价的试验方法
FDA推荐的生物等效性试验方法包括体内和体外的方法。按方法的优先考虑程度从高到低排列如下:
(1)(i)药代动力学法:测量生物样本(如全血,血浆,血清,或其他生物样本) 中药物的活性成份,或其代谢产物的浓度与时间的关系;(ii)体外法:此种方法具有已确立好的体内外相关关系,可用于预测人体生物利用度的相关数据;(2)人体体内法:测量尿样样本中药物的活性成份,或其代谢产物的浓度与时间的关系;(3)药效法:测量药物的活性成份,或其代谢产物的即时药效与时间的关系。应用此种方法,药物效果必须能够被准确地、精确地、重复性地测出;(4)临床试验法:通过设计良好的临床比较试验,以综合的疗效终点指标来确立生物等效性。这种方法在准确性、敏感性和重复性上,较之其它方法有欠缺;(5)体外方法(通常为体外溶出度测定法):能够确保体内生物利用度;(6)FDA认可的任何其它用于测量生物利用度和生物等效性的方法。
对于全身作用类药物,其治疗效果是药物是进入血液循环后产生的,作用部位的药物浓度和血液中药物浓度存在一定的比例关系,因此可以通过测定血液循环中的药物浓度来获得反映药物体内吸收速度和程度的主要药代动力学参数,间接预测药物制剂的临床治疗效果,以评价制剂的质量。药代动力学法是目前公认的最佳方法。一般认为,此法在准确度、精确度、 重复度上最为良好。
对于某些药物来说,如对它们的物理、化学及生物性质对其生物利用度的影响已有足够的了解,证明已无必要进行生物等效性的评估,这类药物则可被豁免其人体生物等效性试验。
生物等效性评价:
药代动力学法
最常规的生物等效性评价设计方法采用单剂量,交叉设计。在某些特殊情况下,平行设计和重复设计也可被采用。一般情况下,选用的受试者应为具有代表性的健康人群。测量的对象是血液或尿液中的药物成分。图1所示的是一个典型的血药浓度曲线,通过此曲线可以获得以下参数:
·Cmax(峰浓度):血药浓度曲线中最高浓度点;
·AUC0-t:药物浓度与时间曲线下的面积,可用梯形法计算;
·Tmax:达到达峰浓度的时间;
·AUC∞:药物浓度与时间曲线被无限延伸所得的面积。AUC∞= AUC0-t + Clast/ke。 (t为最后一次可实测血药浓度的采样时间;Clast为末次可测定样本药物浓度;ke。为对数浓度-时间曲线末端直线部分求得的末端消除速率常数)
达峰浓度通常与药物吸收速度相关,而AUC则反映药物吸收的程度。因此,这两个参数与药物的安全性及有效性密切相关,而它们也由此被作为生物等效性评价的关键参数。
1.试验设计
在标准化的、交叉设计的生物等效性评价的试验过程中,受试对象被随机分为几组,按一定顺序处理,一组受试者先服用单剂量受试制剂,然后服用单剂量参比制剂;另一组反之。两种制剂的服用需间隔足够长的清洗期。清洗期的时间长度一般定为药物活性成分的5个以上的消除半衰期长度。有时有些药物或其代谢物的消除半衰期很长,难以按此设计方法实施,在此情况下可以考虑按平行设计进行,但此法需要增加样本量。一般情况下,给药方法推荐单剂量给药法,原因是较之于多次给药,单剂量给药对于药物进入人体吸收的过程更为敏感。
2.给药剂量
在生物等效性评价的研究中,如药物有多种剂量,一般选用最高剂量药物来做生物等效性评价的研究。绝大部分药物的药代动力学具有良好的吸收,分布和消除曲线,药物吸收速率的增长与服用剂量的增长呈线性关系。因此,对一个剂量的生物等效性研究的结论,同样可以适用于其它剂量。但如果选用最高剂量药物作为生物等效性评价的试验会对人体安全性产生影响,FDA则会推荐低剂量给药。
对于吸收速率与服用剂量呈非线性关系的药物,应选择最敏感的剂量给药,以便区分产品剂型上的区别。呈非线性药代动力学最常见的原因是代谢饱和,即代谢达到最高饱和点,不再依赖药物浓度的变化而变化。另外一种非线性药代动力学可能的原因是药物的溶解度限制了药物的吸收,或是体内细胞运输受体达到饱和状态。
3.受试者
由于生物等效性评价参数是与统计相关的参数,因此,应选择足够受试者人数来确保试验成功。一般来讲,大多数药物评估采用24~36例即可,也有选用12例(最低限度)。等效性评价研究应选择健康受试者,其主要原因有二:其一,病人做受试者会有很大的变异性,这种大的变异性直接影响到生物等效性评价的灵敏度;其二,病人必须得到持续性的治疗,而清洗期的插入会中断治疗的持续性。因此,只有当药物对健康受试者的安全产生危害的情况下,才会选用病人作为受试者。
一般来讲,固体药物吸收的过程对健康受试者和病人来说是相同的。同时,生物等效性评估的是两种制剂吸收程度和速度的相对比较,所以,从健康受试者身上得到的结论同样适用于病人。对于某些药物来说,病人与健康者对其生物吸收度并不相同,即便对于这类药物, 如上结论基本上同样成立。