
动物细胞规模化培养
Why mammalian cells?
Some cases for large scale vaccine production
transient expression in large scale
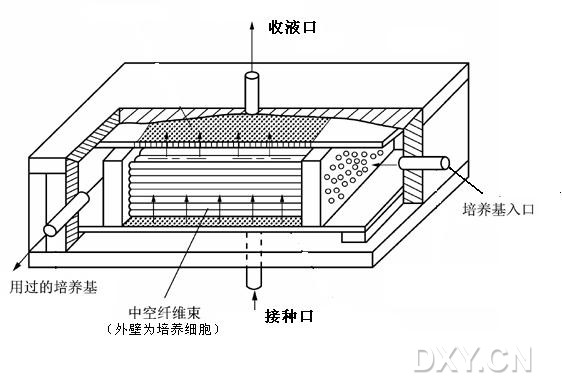
bout hollow fiber bioreactor

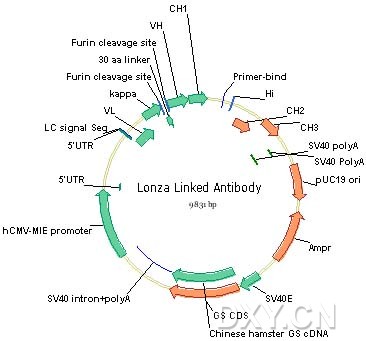
Cell lines in production of antibody
Chemically defined or Serum free?
GS or DHFR?
Formulations and its issues in scale up
| 欢迎光临 分析测试百科 (http://bbs.antpedia.com/) | Powered by Discuz! 5.5.0 |