查看完整版本请点击这里:
【求助】蛋白表达形成高聚!
大家好,我目前在做一个大概110kD的的蛋白,过完Ni柱后蛋白挺多的!经SDS确定是110kD的蛋白!后续经过浓缩后去做分子筛,结果发现8ml左右出来一个较高的峰,而正常13ml峰特别低,有时没有!8ml左右出来的是高聚,后来试过其他的方法!如添加DTT,10%甘油,改变NaCl浓度,改变pH值等都没有效,所以来问问大家有碰到过这个高聚的问题吗?有什么好的方法吗?推荐下,谢谢!! 【求助】蛋白表达形成高聚!
查看完整版本请点击这里:
【求助】蛋白表达形成高聚!
【求助】蛋白表达形成高聚!
83175101.png



最新回复
喵咪 (2013-12-16 22:58:09)
你怎么确定8ml出来的就是你的蛋白的聚合体。有没有试过加表面活性剂如tween,sds之类的
viviwang1987 (2013-12-16 22:58:27)
8ml蛋白跑过电泳啊!确定是我的蛋白!对照该柱子的情况是分子量比我的大很多菜出来的,所以认为是高聚了!没试过表面活性剂,这个主要是什么作用?
txwuyan (2013-12-16 22:58:44)
我估计不是蛋白的高聚,你有没有检测一下你的两个峰,如果是杂蛋白呢。用你的检测手法检测一下
阿k (2013-12-16 22:59:03)
先低浓度上样看看,但是你这图上的吸收峰很低,看上去蛋白不多啊
xueyouzhang (2013-12-16 22:59:19)
过Ni柱后用SDS可能就有问题,应该用非还原电泳看看,可能已经形成高聚了。所以对付高聚要从开始做就要注意添加东西。
阿k (2013-12-16 22:59:38)
viviwang1987 (2013-12-16 22:59:54)
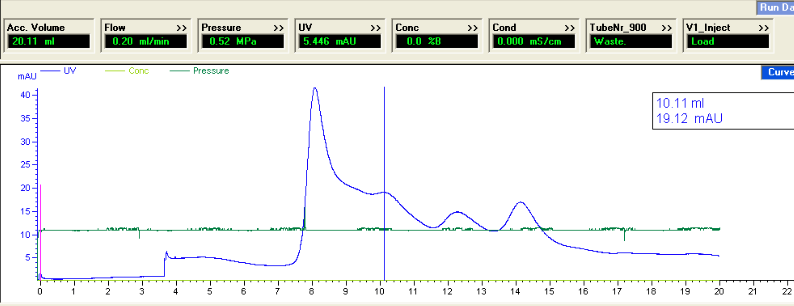
对,是SDS-PAGE确定是110kD,没有加SDS,上面那个图其实是5ml Ni柱(总共50ml)下来的蛋白跑的分子筛,估计Ni柱下来就高聚了! 而不是后面操作照成的!真不知道怎么办?
seagate (2013-12-16 23:00:26)
首先确定一下,你的得到的蛋白的目的,检测活性?如果是,活性形式是单体,还是多聚?
关于聚集,还原剂是全程加,还是洗脱出来后再添加的?浓度够不?最好跑一个非还原胶看看。
如果还原剂足够,那么聚集不是由于二硫键而引起,可能是疏水性聚集,打开的话需要添加表面活性剂或者其它解聚性的试剂。
seagate (2013-12-16 23:00:48)
跑SEC的时候,用NI柱的洗脱液做平衡液,这样可以知道聚集是因为换buffer,还是洗脱时就已经形成。
viviwang1987 (2013-12-16 23:01:16)
这个做过了!结果一样!还是一样形成高聚了!所以判断是在Ni柱中就形成高聚了,或者细胞破碎出来就高聚了!由于这个蛋白是结合DNA的,所以我下次打算直接在细胞破碎前的原液中加入足够量的DNA,看看结果怎么样!这样行吗?
dreaming (2013-12-16 23:01:40)
【求助】蛋白表达形成高聚!