查看完整版本请点击这里:
【求助】非变性活性电泳,遇到些问题不知怎么解决
最近在做非变性活性电泳,遇到些问题不知怎么解决。我的实验步骤如下:【求助】非变性活性电泳,遇到些问题不知怎么解决
1.电泳:分离胶交联浓度12%,加SDS,与普通变性胶一样,浓缩胶不加SDS,上样缓冲液和电泳缓冲液均不加SDS。冰水混合物中电泳,电压100v.
2.洗去SDS:2.5%Triton X-100 振荡1h.之后pH7.2磷酸盐缓冲液洗3次。
3.反应:50度下 泡在酪蛋白溶液中反应30min.
4.考染脱色
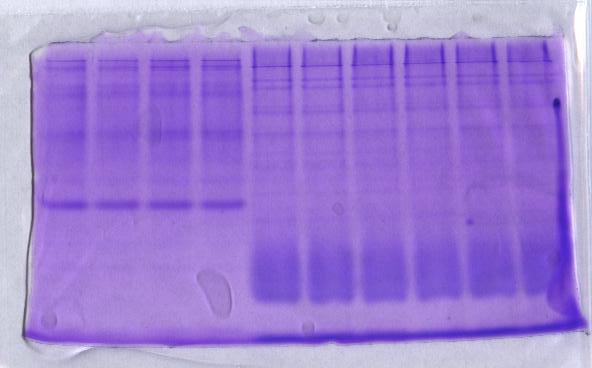
如图:
两种样品,空白区域太大,可能是酶活高,未稀释。
另外,我想拿胶去做质谱鉴定,不知可不可以。酶将酶本身及周围区域的酪蛋白和周围的蛋白(?会不会分解周围原有的蛋白)都分解,显示白色,做个对照不加酪蛋白的对比下,看哪个条带继续存在就是酶的条带,不知对不对?然后去鉴定。
这两张图,貌似也看不出来。还有什么好的办法啊。我就想弄清同工酶的种类。
查看完整版本请点击这里:
【求助】非变性活性电泳,遇到些问题不知怎么解决
【求助】非变性活性电泳,遇到些问题不知怎么解决

1240657_1334276318_360.jpg
1240657_1334277571_505.jpg



最新回复
xgy412 (2016-3-03 11:52:04)
efp (2016-3-03 11:52:27)
能不能不加SDS?这东西也算是个变性剂。
能不能跑胶结束后贴在平板上显色?
女儿情 (2016-3-03 11:52:46)
wawa11 (2016-3-03 11:53:09)
Native-PAGE 12% 0415-2.jpg
SDS-PAGE 12% 0416-1.JPG
【求助】非变性活性电泳,遇到些问题不知怎么解决